Als im Jahre 1960 Charles J. Pedersen den vielzähnigen phenolischen Ether 16 als Liganden herstellen wollte, mit dem er die katalytische Aktivität der Vanadylgruppe VO untersuchen wollte, bemerkte er, dass aus einer Lösung seines Rohproduktes eine faserige, farblose Substanz auskristallisierte. Pedersen wusste, dass das Zwischenprodukt 13 mit etwa 10 % Brenzcatechin (11) verunreinigt war, verzichtete jedoch auf eine Reinigung, da das Endprodukt 15 in jedem Falle noch aufgereinigt werden sollte. Pedersen untersuchte die Kristalle und stellte durch IR-Spektroskopie fest, dass das Produkt keine freien OH-Gruppen enthielt und sich in Methanol schlecht löste. Bei Zugabe von NaOH und anderen Natriumsalzen wurde eine enorme Steigerung der Löslichkeit in Methanol festgestellt. Als Pedersen das Ergebnis der Massenspektrometrie erhielt, konnte er darauf schließen, dass er in Wirklichkeit den aromatischen, zyklischen Polyether 17 synthetisierte, den er Kronenether taufte. Ihm wurde klar, dass das positiv geladene Natriumkation von den sechs negativ polarisierten Sauerstoff-Atomen komplexiert wurde (Struktur 18).[12]
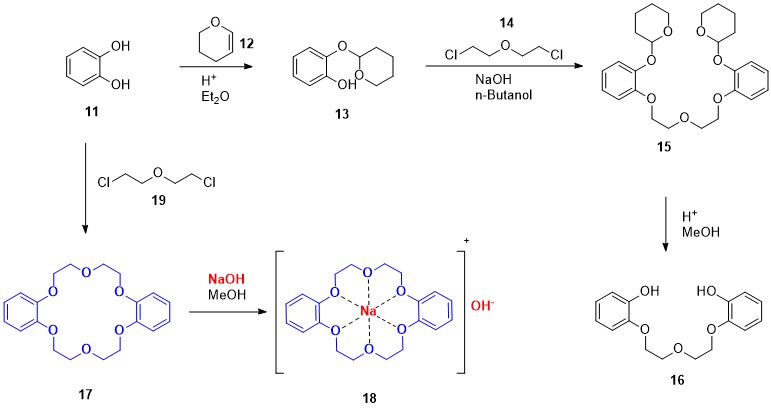
Schema 1: Synthese des ersten Kronenethers 17.
In den weiteren Jahren stellten Pedersen und seine Mitarbeiter eine Reihe weiterer Kronenether mit unterschiedlicher Ringgröße des Makrozyklus und unterschiedlicher Anzahl an Sauerstoff-Atomen her. Er fand heraus, dass die Größe des Hohlraums mit der der Größe des Makrozyklus korreliert und konnte auf diese Art und Weise eine ganze Reihe verschiedener Kronenether herstellen, die für bestimmte Kationen optimal zur Komplexierung geeignet sind. Breite Anwendung finden Kronenether, um die Löslichkeit von Salzen in organischen Lösungsmitteln drastisch zu erhöhen und die Reaktivität des „nackten“ Anions zu steigern. So wird zum Beispiel der Einsatz von Dicyclohexyl[18]-Krone-6 20 beschrieben, um das sonst in Benzol nahezu unlösliche Kaliumpermanganat löslich zu machen und für Oxidationen bei milden Bedingungen einzusetzen.
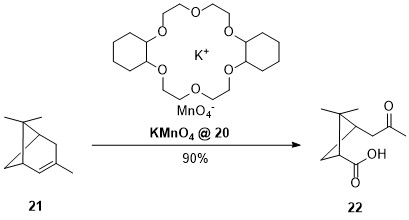
Schema 2: Synthese von Pinolencarbonsäure 22.
So wird α-Pinen 21 in Benzol mit 90 % Ausbeute zur Pinolencarbonsäure 22 oxidiert (siehe Abb. 2), während die Oxidation in wässrigem Medium mit Kaliumpermanganat nur mit 40-60 % Ausbeute verläuft.[13]