Supramolekulare Chemie
Im Jahre 1987 erhielten Jean-Marie Lehn, Donald J. Cram und Charles Pedersen den Nobelpreis für Chemie „für ihre Entwicklung und Verwendung von Molekülen mit strukturspezifischer Wechselwirkung von hoher Selektivität“. Lehn war es auch, der den Begriff der supramolekularen Chemie definierte. Unter supramolekularer Chemie versteht man die nicht-kovalente Interaktion zwischen einem Wirt- und einem Gastmolekül.[1]
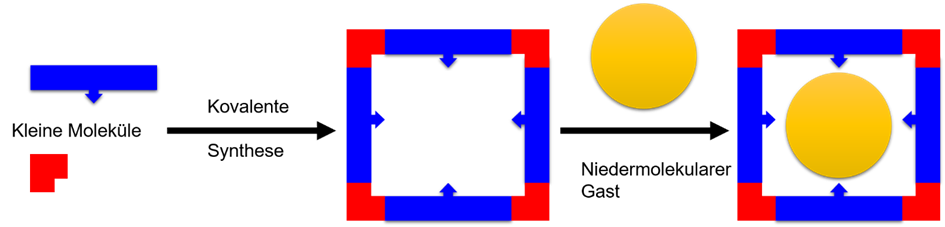
Abbildung 1: Prinzip der supramolekularen Chemie: Nicht-kovalente Wechselwirkung zwischen einem Wirt- und einem Gastmolekül.
Die Entwicklung der supramolekularen Chemie startete mit dem Verständnis der selektiven Bindung von Ionen mit natürlichen und synthetisch hergestellten Liganden. Die prominentesten Vertreter, die in den 60er und 70er Jahren entwickelt wurden, sind die Kronenether[2] (Pedersen), Cryptanden[3] (Lehn) und Spheranden[4] (Cram).
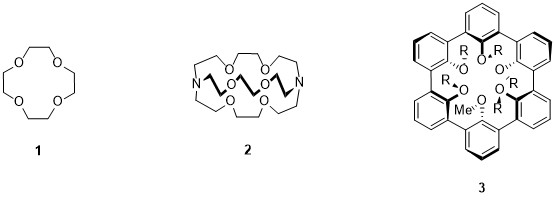
Abbildung 2: Kronenether 1, Cryptand 2 und Spherand 3.
Wirt- und Gastmoleküle werden durch verschiedenste intermolekulare Wechselwirkungen (WW) zusammengehalten.[1] Zu diesen Wechselwirkungen zählen die Ion-Ion-WW, Ion-Dipol-WW, Dipol-Dipol-WW, Wasserstoffbrückenbindungen, Kation-π-WW, π-π-WW und die van-der-Waals-WW. Die Ion-Ion-Wechselwirkungen[5] sind sehr starke intermolekulare Wechselwirkungen (25-100 kcal/mol). In wässriger Lösung müssen die Solvathüllen der Anionen und Kationen verdrängt werden, damit ein direktes Kontaktionenpaar vorliegen kann. Die Stärke der Wechselwirkung hängt sowohl von Abstand und Ladung der Ionen als auch von der Dielektrizitätskonstante des Lösungsmittels ab.

Abbildung 3: Ionenbindung zwischen Na+-Ion (blau) und Chlorid-Ion (gelb).
Ion-Dipol-Wechselwirkungen sind starke Wechselwirkungen zwischen einem Ion und einem polaren Molekül. Als prominente Beispiele gelten hierbei die Kronenether für die selektive Komplexierung für Alkalimetallionen.[6]
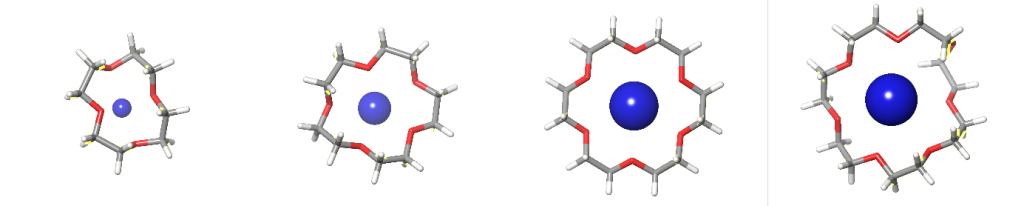
Abbildung 4: von links nach rechts: 14-Krone-4 komplexiert Li+-Ion, 15-Krone-5 komplexiert Na+-Ion, 18-Krone-6 komplexiert K+-Ion und 21-Krone-7 komplexiert Rb+-Ion.
Dipol-Dipol-Wechselwirkungen[7] sind mittelstarke Wechselwirkungen (2-12 kcal/mol) und sorgen bei Carbonylverbindungen wie Aldehyden und Ketonen für einen im Vergleich zu den jeweiligen Alkanen höheren Siedepunkt (Sdp. Propan -42.1 °C und Sdp. Aceton 56 °C).
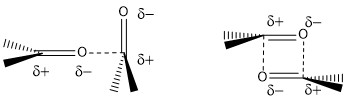
Abbildung 5: Dipol-Dipol-Wechselwirkungen zwischen zwei Ketonen.
Wasserstoffbrückenbindungen (H-Brücken)[8] sind ebenfalls mittelstarke Bindungen (1-15 kcal/mol), die zwischen Wasserstoffbrücken-Donoren und -Akzeptoren auftreten. Als Donoren eignen sich z.B. -SH, -OH und NH, Akzeptoren können N, O, S und Halogene sein. H-Brücken sind in biologischen Systemen von überragender Bedeutung. Der Zusammenhalt von Proteinen und DNA wird größtenteils von ihnen bestimmt. Die Stärke der H-Brücken hängt vom Abstand D___H……A (D = Donator, A = Akzeptor, H = Wasserstoff) und von dem Bindungswinkel ab.

Abbildung 6: Adenin (4)-Thymin (5)-Wasserstoffbrücken, rechts: Guanin (6)-Cytosin (7)-Wasserstoffbrücken-bindungen.
Kation-π-Wechselwirkungen[9] sind starke Wechselwirkungen zwischen elektronenreichen π-Systemen (z.B. aromatischen Systemen). So konnte durch Massenspektrometrie und Cyclotronresonanz-Studien gezeigt werden, dass Alkalimetallionen hohe Affinitäten für simple aromatische Moleküle zeigen. Auch Alkylammoniumionen zeigen über eine X-H-π-Anziehung starke Kation-π-Wechselwirkungen. In dem Virusprotein VP39 wird zwischen der positiv geladenen Arginin-Seitenkette und einer Tyrosin-Seitenkette eine π-Kation-Wechselwirkung zur Stabilisierung der α-Helix ausgenutzt.
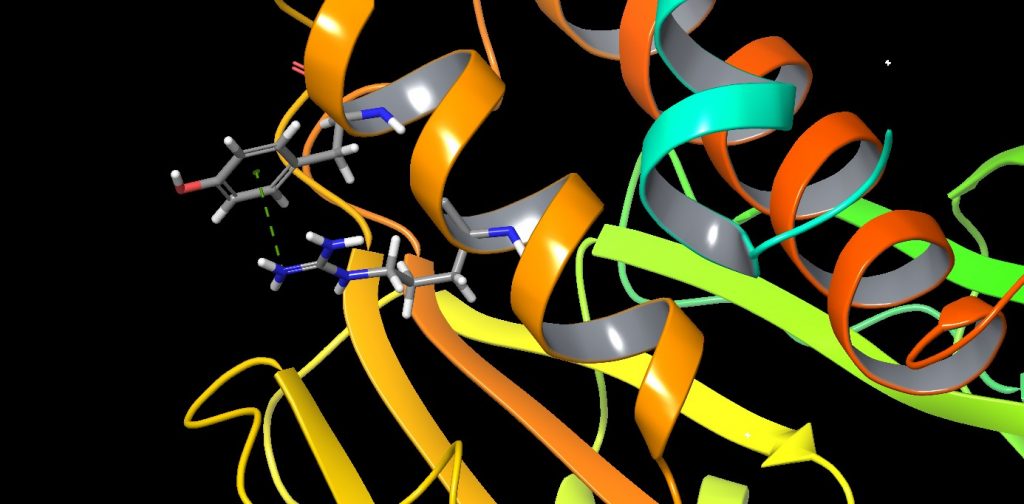
Abbildung 7: Stabilisierung einer α-Helix durch die Kation-π-Wechselwirkung zwischen einem positiv geladenen Arginin-Rest und einem aromatischen Tyrosin-Rest in dem Virus-Protein VP39 (PDB: 1V39).
π-π Wechselwirkungen[10] sind Anziehungskräfte, die zwischen aromatischen Molekülen gefunden werden. Man unterscheidet hierbei zwischen einer Face-to-Face und einer Edge-to-Face Anordnung. Prominentes Beispiel ist hierfür das Benzol (8).
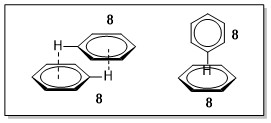
Abbildung 8: links: Face to-Face-Anordnung des Benzols (8), rechts, Edge-to-Face Anordnung des Benzols.
Van der Waals Wechselwirkungen[ sind sehr schwache Wechselwirkungen zwischen polarisierbaren, benachbarten Molekülen. Je größer die Kontaktfläche der einzelnen Moleküle ist, desto stärker ist in der Regel die van-der-Waals Wechselwirkung. In unpolaren Verbindungen, wie z.B. Alkanen sind dies die einzigen intermolekularen Wechselwirkungen, die mit zunehmender Kettenlänge stärker werden.
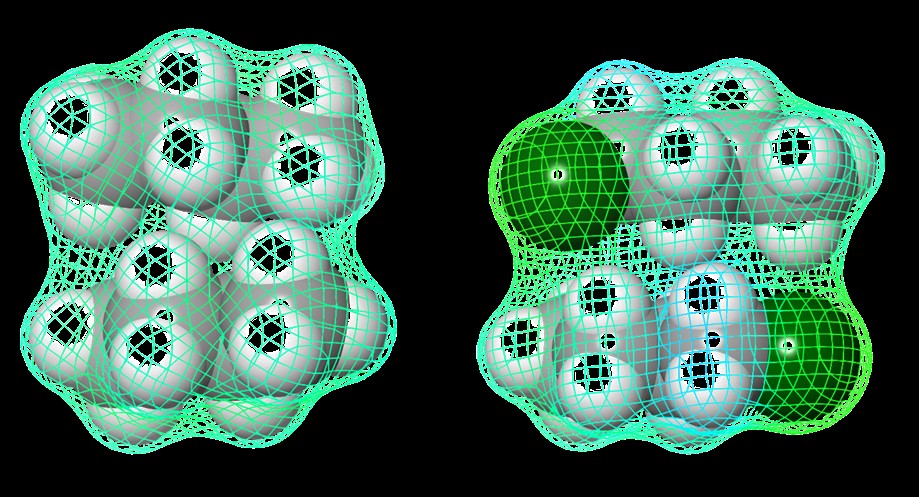
Abbildung 9: Van-der-Waals Wechselwirkungen zwischen Butan (9) und 1-Chlorbutan (10).